La masa atómica está definida como la masa de un átomo, que solo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos.
En el caso de muchos elementos que tienen un isótopo dominante, la similitud/diferencia numérica real entre la masa atómica del isótopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta a muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales.
El peso atómico estándar se refiere a la media de las masas atómicas relativas de un elemento en el medio local de la corteza terrestre y la atmósfera terrestre, como está determinado por la Commission on Atomic Weights and Isotopic Abundances (Comisión de Pesos Atómicos y Abundancias Isotópicas) de la IUPAC. Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios.
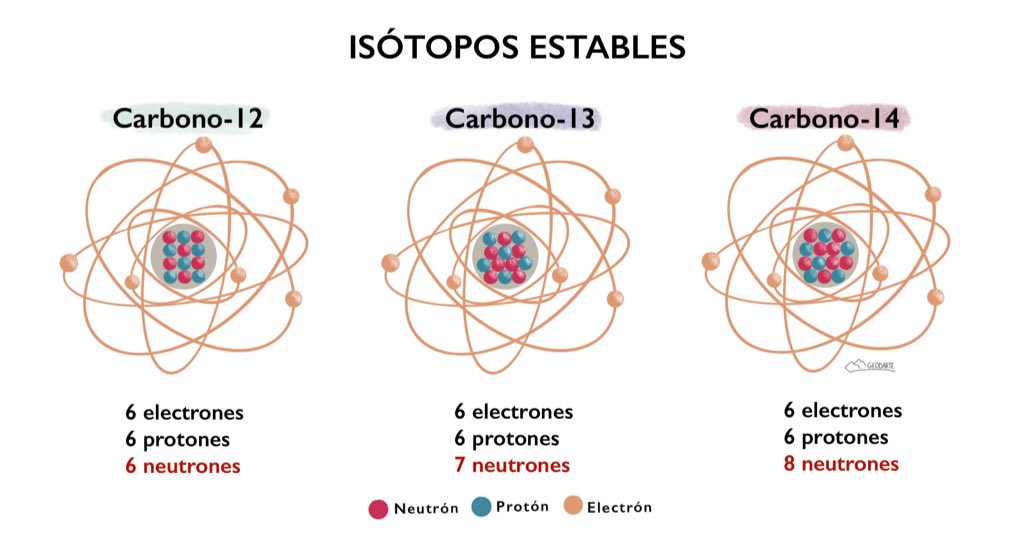
Se denomina isótopos a los átomos de un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones, y por lo tanto, difieren en número másico.La palabra isótopo se usa para indicar que todos los tipos de átomos de un mismo elemento químico se encuentran en el mismo sitio de la tabla periódica.
el carbono 12, el carbono 13 y el carbono 14 son isótopos de carbono.


No hay comentarios:
Publicar un comentario